3 �@�����z������ƁH
�@1�D���̋z���@���������Ɗւ����i�K�́C������������荞�މߒ��܂����̋z���ł��B���̉ߒ��ɂ��Ă̓A�C���V���^�C���̗��_������܂����C�����ł͗����܂��B
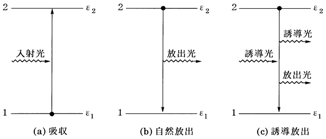
�@(a) �v�����N�ɂ��ƕ����������ꂼ����G�l���M�[�͘A���ł͂Ȃ��C�s�A���ł��B���������s�A���Ȋe��Ԃ̃G�l���M�[���G�l���M�[�����i�P�ɏ��ʂƂ������Ƃ������j�Ƃ����C�}�ł͂��̃G�l���M�[�ɑ������鍂���̏��ɒZ���������ŕ\�킳��܂��B�}1a�̂悤��2�̏��1�����2�̃G�l���M�[����1, ��2�i��1����2�j�Ƃ���ƁC������h���Ƃ����G�l���M�[�������������z�����ď��2�ɏオ�邽�߂ɂ́C2�̏�ԊԂ̃G�l���M�[�����Á���2 -��1��h���łȂ���Ȃ�܂���B

�}1�@���̋z����2��ނ̌����o�i�����_�͓d�q��\�킷�j
�@�������G�l���M�[�I�Ɏ�肤���Ԃ̂����C�G�l���M�[�I�ɍŒ�̏�Ԃ������ ground state�C�������������Ԃ���N��� excited state�Ƃ����܂��B�}1�ł͏��2����N��Ԃł����C���1�͕K����������ԂƂ͌��炸��ʂɂ̓G�l���M�[�I�ɍ�����Ԃ̂��Ƃ�����܂��B��̓I�ȏ�Ԃ̗�́u3�D��N��Ԃ̂��낢��v���Q�Ƃ��ĉ������B
�@(b) ���z���ɂ���Ċ���Ԃ����N��Ԃɏオ��Ƃ��C����Ԃ̓d�q��1��N��Ԃɏ�����܂��i�}a�j�B�d�q�̓G�l���M�[�I�ɕs�A���ȏ�ԊԂ��C����ΐ���щz����悤�ɔ�яオ��̂ł��B������J�� transition�Ƃ����C�d�q���J�ڂ��邱�Ƃ��d�q�J���Ƃ����܂��B
�@(c) �}1��2�̏��1, 2�́C���̕����ɌŗL�́C�����̕���������̏�Ԃł��B���̂悤�ɂ����Ԃ��u�`�̏�Ԃł���v�Ɠ��肷�邱�Ƃ��A�� assignment�Ƃ����C����z���т����A������B�ւ̑J�ڂ��A���������Ƃ������L����A �� B�ƕ\�킵�܂��B�z���X�y�N�g���┭���X�y�N�g���ɂ����Ă͋A���͂܂����ɏd�v�Ȃ��Ƃł�����C�A���ł��Ȃ��ꍇ�͋A�����̂��傫�Ȍ����ړI�ɂȂ�܂��B
�@(d) �����ɂ͂��ꂼ��ɌŗL�̃G�l���M�[���ʂ�����C�]���ċz��������̔g�����Ⴄ�̂ŖڂɌ�����F���獷���ʂł��B�������ǂ̔g���̌����ǂ̒��x�z�����邩���O���t�ɕ\�킵�����̂��z���X�y�N�g�� absorption spectrum�Ƃ����C�ʏ�͏c���ɋz���x�C�����ɔg���i�܂��͔g���j�����܂��B�z���x absorbance�i�L��D�j�́C�����Ɍ������˂��鋭�x�i���ˌ����x�jIo�C���ߌ��̋��xI �Ƃ̊Ԃɐ��藧�W���i�����o�[�g�E�x�[���̖@���j�ɂ���Ď��̂悤�ɕ\�킳��܂��B
I��Io e-��cd�i�����o�[�g�E�x�[���̖@���j�@�@(6)
D��log (Io�^I)�@�@(7)
�@����cd�@�@(8)
c�͗n�t�̃����Z�x(�����^l)�Cd�͌���������ʉ߂��钷�������H���Ƃ����C�����̓������e��i�ʏ�͌����ߐ��̃K���X�łł����Z�����w���j�̕��ɑ������܂��B���͕����ɓ��L�̒萔�������z���W���Ƃ����C�ǂ��g���������z���W���Ái��q�̃G�l���M�[�Ɠ����L���ł����C�Ӗ��͈قȂ�j�Ƃ̊Ԃɂ�
����2.303��cd�@�@(9)
�̊W������܂��B
�@(e) �z���X�y�N�g���ɂ͊���̎�ނ�����܂��B���q�̏ꍇ�͕s�A�������琬�����X�y�N�g���ł����C�����̑����q���q�≻�����̋z���X�y�N�g���͈�ʂɎR�̂悤�ɕ��L���`�������z���� absorption band�������܂��B���̋z���x�ő�̏����z���ɑ��C���̔g�����ɑ�g���i��max�j�Ƃ����܂��B����͌�q�̐}7�`8�����ĉ������B
�@(f) ��ŏq�ׂ�(a), (e)����C�����������z�����邽�߂ɂ͎���2�̏������K�v�ł��B
�@ 2�̏�ԊԂ̃G�l���M�[���ɑ�������g���̌��Ă�
���̂��߂Ɏg����g���̌�����N���C�g������N�g���Ƃ����܂��B
�@�A ���̕����̋z���тɑ�������g���̌����Ǝ˂��Ȃ���Ȃ�Ȃ�
2�D�X�s�����d�x�@�����w�ł͂��܂��܂ȃX�s�����d�x�����e��̗�N��Ԃ������܂��B�]���Ă����m���Ă����Ȃ��ƌ����w�͂Ȃ��Ȃ��ʔ����������܂���B
�@�d�q�͉E���C�����̂悤�Ȑ����Ƃ����Ă悢�X�s���̐����������Ă��܂��B���̐�����\�킷�̂��X�s�����C�ʎq���ƌĂ��ʎq���ŁC�Ⴆ�Γd�q1�ɂ��ĉE���i��j��1/2�Ƃ�������i��j��-1/2�Ƃ������l�����܂��B�����C���̌����͔��ɂ��Ă��\���܂���B�d�q����������ꍇ�́C�X�s���̌������l�������S�̂̐��l���Ȃ킿�S�X�s���ʎq���i�L��S�j�����߂܂��B���̂Ƃ�2S�{1�ŕ\�킳���ʂ��X�s�����d�x�i�L��M�j�Ə̂��C���lM����������Ԃ�M�d���Ƃ����̂ł��B�X�s�����d�x�͍���\�킷�L���̍���ɐ����Ŏ����܂��B�Ⴆ����B�Ƃ���Έȉ��̂悤�ɂȂ�܂��B
�i��1�j�d�q1�̏ꍇ��S��1/2��M��2�i��d�� doublet, 2B�j
�i��2�j�d�q2���X�s���������̏ꍇ��S��0�CM��1�i��d�� singlet, 1B�j�C�X�s�����s�����̏ꍇ��S��1�CM��3�i�O�d�� triplet, 3B�j
�i��3�j�d�q3�ŃX�s���������̏ꍇ��S��3/2�CM��4�i�l�d�� quartet, 4B�j�C�X�s���������̏ꍇ��S��1/2�CM��2�i��d�� doublet, 2B�j�ȂǁB
�@3�D��N��Ԃ̂��낢���@���z���ɂ���Ăǂ�ȗ�N��Ԃ������邩�͂ǂ̋z���т��N����̂��Ƃ������ƂƖ��ڂɊ֘A���܂����C�����ł͒P�Ɉ�ʓI�ɍl������ꍇ���q�ׂ܂��B
�@(a) �L�@���q�i�}2�j�F����Ԃ̓X�s������������d��S0�ł��B����Ԃ���d�q��1�J�ڂ��ė�N��ԂɂȂ�ꍇ�C��ʂ肪����܂��B��͓d�q���X�s����ς��Ȃ��őJ�ڂ��C����ԂƓ�����d���ɂȂ�ꍇ�ł��B���̗�N��Ԃ�����ԂƋ�ʂ�����N��d����� excited singlet state�i�L��S, S1���邢��1S, 1S1�Ȃ��j�Ƃ����܂��B�}�����Ă��܂��G�l���M�[�I�ɂ���ɍ������ɂ����C��O��N��d��,����i�L��S2, S3,����j������܂��B��������d�q���X�s���]���đJ�ڂ��C�X�s�����s�̎O�d���ɂȂ�ꍇ�ł��B��d���̊���ԂƋ�ʂ���K�v���Ȃ��̂��Œ�O�d����� lowest triplet state�i�L��T, T1���邢��3T, 3T1�Ȃǁj�ƌĂсC��N�O�d���Ƃ͌����܂���B���̗�N��d���ƎO�d���̓Z�b�g�ő��݂��iS1��T1, S2��T2,����j�C�O�d���̕����G�l���M�[�I�ɕK���Ⴍ�Ȃ�܂��B
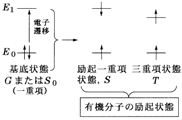
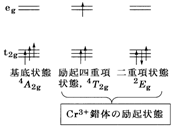
�}2�@�L�@���q�̗�N��� �}3�@Cr3+���̗̂�N���
�@(b) �J�ڋ������́F�����ɂ����d�d�q�����قȂ�C�]���ăX�s�����d�x���قȂ�̂ŗL�@���q�̂悤�Ɉꗥ�Ɉ������Ƃ��ł��܂���Bd�d�q���ň����̂��֗��ŁC��Ƃ��Đ}3��d�d�q��3�id3�n�j�̃N����(�V)�̏ꍇ�������܂����B����ԂƓ����l�d���̗�N��Ԃ�����܂����C�L�@���q�Ƃ͈���ČX�̏�ԂɌŗL�̋L�����t�����Ă��܂��B
�@4�D�d�q��N��ԂƐU�������@3�ŏq�ׂ���N��Ԃ͓d�q�J�ڂɂ���Đ����܂������d�q��N��� electronic excited state�ƌĂ�C��{�̐��������Ȃ킿�G�l���M�[���ʂŎ�����Ă��܂��B�}�ł͏ȗ�����Ă��܂����C���͂��̂悤�Ȋe�d�q��N��Ԃɂ͕��q�̐U���^���ɔ����U������ vibrational level�ƌĂ��G�l���M�[���ʂ�����ɂ����āC���ꂼ��͐U���ʎq�� v�i��0, 1, 2, ����j�ɑΉ����Ă���̂ł��i�}4�j�B���܂ň�{�̐��Ŏ������d�q��N��Ԃ͐U������0�̏��ʂɑ������Ă���C���ۂɂ͂���������ƃG�l���M�[�̍����U�����ʂ�����܂��B
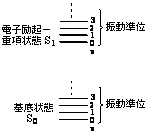
�@�@�@ �}4�@�U������
�@5�D���܂��܂ȋz���i���邢�͑J�ځj�@�z���X�y�N�g���ɂ͕����ɂ���Ċ���̋z���p�^�[��������܂��B
�@(a) ��-��*�J���F�Γd�q�n�F�����L�@�������ɓT�^�I�ȋz���ŁC����Ԃ̃Ώ�Ԃ����*��N��Ԃւ̓d�q�J�ڂɊ�Â��܂��B�͓d�q����߂�G�l���M�[�̒Ⴂ�O���̂����ŃG�l���M�[�ō��̏�Ԃł���C��*�͓d�q����߂Ă��Ȃ��G�l���M�[�̍����O���̂����ŃG�l���M�[�Œ�̋O���ł��B
�@ n-��*�J���F�փe���F�����Ɍ�����z���B�Ⴆ�Β��fN���܂ޕ��q�ɂ́CN�̔L�d�q�̂���1�̓d�q����*�O���֑J�ڂ��邱�Ƃɂ���Ă��̋z���������܂��B
�@(b) �J�ڋ������̂̋z���F�J�ڋ������̂ɂ͈ȏ�̂ق��Ɏ��̂悤�ȋz��������܂��B
d-d�J���F���̓��L�̋z���ŁCd�O���Ԃ̑J�ڂɊ�Â��̂ł��̂悤�ɌĂ�܂��B���̂ق��Ɍ�����z���C�z�ʎq��z���ȂǂƌĂ�邱�Ƃ���������܂��B
�d�ړ��J���F����-�z�ʎq�Ԃ̑J�ڂɊ�Â��z���ŁC�ʏ�͓d�ړ�charge transfer�̓������������CT�z���ƌĂ�Ă��܂��BL(�z�ʎq) �� M(����)�ւ̌����ɋN����LMCT�ƁCM �� L�ւ̌����ɋN����MLCT��2�ʂ肪����܂��B[Ru(bpy)3]2+��MLCT�z���CMLCT�����̗�Ƃ��ėǂ��m���Ă��܂��B
�@�@�@�z�ʎq�J���F���̂��\������z�ʎq���̂ɂ��z���ŁC�����̓�-��*�J�ڂ̌��ʂł��B
�@(c) ���J���F2�̏�ԊԂ̓d�q�J�ڂ�������Ȃ��ꍇ�����e�J�ځC�������ꍇ�����J�ڂƂ����܂��B�����X�s����������2�̏�ԊԂ̓d�q�J�ڂ̓X�s�����e�J�ڂł���C�قȂ�X�s����������2�̏�ԊԂ̓d�q�J�ڂ͌�������������X�s�����J���ł��B�Ⴆ�ΗL�@���q�ł�S1 �� S0�̓X�s�����e�J�ځCS1 �� T1��T1 �� S0�̓X�s�����J�ڂł��B
�@�X�s�����e�J�ڂ͋��x�������C�����z���W�����傫�Ȓl�i�Á�104�j�����܂����C�X�s�����J�ڂ͋��x�����Ɏキ�C�����z���W���͏����Ȓl�i����10�j�ɂȂ�܂��Bn-��*�J�ڂ����R���قȂ�܂������J�ڂł��B
�@(d) ���z���ŗD��I�ɐ������N��Ԃ́H�F�����o�[�g�E�x�[���̎�(6)���番��悤�ɁC���������悭�z������̂̓����z���W���Â̑傫�ȋz���тł��B����������X�s�����J�ڂɂ��z���́C�Â����������߂Ɍ����z�������Ƃ��Ă����̗�N��Ԃɑ��݂��镪�q�̐����������C�������č����x������܂���B�]���Č��z���ɂ���Đ������N��ԂƂ��Ă܂��l�����ׂ����̂́C�L�@���q�ł̓X�s�����e�̃�-��*�J�ڂɂ���Đ������N��d�����S1�ł���C�Œ�O�d�����T1�ł͂���܂����B�]���ĎO�d�����T1�͂��̃Z�b�g�̑���S1���o�R���Đ�����̂����ʂł��B